teoria de banda
(2.12) Teoria de banda
La teoría se basa en el hecho de que en una molécula los orbitales de un átomo se solapan produciendo un número discreto de orbitales moleculares.
teoría según la cual se describe la estructura electrónica de un material como una estructura de bandas electrónicas, o simplemente estructura de bandas de energía
la Teoría de bandas considera que los orbitales atómicos de valencia de los N átomos del litio que estarán formando enlace metálico, se combinan entre sí para dar unos orbitales moleculares, pertenecientes a todo el cristal y con energías muy semejantes entre sí. Tan cercanos se hallan energéticamente estos orbitales moleculares formados, que decimos que dan lugar a una banda. Se obtienen tantos orbitales moleculares como orbitales atómicos se combinen.

La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una "banda de energía".
 Los restantes orbitales van teniendo sucesivamente 1, 2, 3... nodos internucleares y sus energías están comprendidas entre la del orbital más enlazante (de menor energía) y la del más antienlazante (mayor energía). La diferencia de energía entre los N orbitales moleculares es tan pequeña que se forma una banda o continuo de niveles de energía. La anchura total de la banda depende de la fuerza de la interacción entre los orbitales atómicos de los átomos vecinos, de forma que, cuanto mayor sea la interacción, mayor será el solapamiento entre los orbitales y mayor será la anchura de la banda resultante (o separación entre el orbital molecular más enlazante y el más antienlazante). La anchura de una banda es, por lo general, una medida del grado de localización del enlace. Una banda estrecha representa un alto grado de localización de un enlace y a medida que se va haciendo más ancha los enlaces se hacen más deslocalizados
Los restantes orbitales van teniendo sucesivamente 1, 2, 3... nodos internucleares y sus energías están comprendidas entre la del orbital más enlazante (de menor energía) y la del más antienlazante (mayor energía). La diferencia de energía entre los N orbitales moleculares es tan pequeña que se forma una banda o continuo de niveles de energía. La anchura total de la banda depende de la fuerza de la interacción entre los orbitales atómicos de los átomos vecinos, de forma que, cuanto mayor sea la interacción, mayor será el solapamiento entre los orbitales y mayor será la anchura de la banda resultante (o separación entre el orbital molecular más enlazante y el más antienlazante). La anchura de una banda es, por lo general, una medida del grado de localización del enlace. Una banda estrecha representa un alto grado de localización de un enlace y a medida que se va haciendo más ancha los enlaces se hacen más deslocalizados
La teoría se basa en el hecho de que en una molécula los orbitales de un átomo se solapan produciendo un número discreto de orbitales moleculares.
teoría según la cual se describe la estructura electrónica de un material como una estructura de bandas electrónicas, o simplemente estructura de bandas de energía
la Teoría de bandas considera que los orbitales atómicos de valencia de los N átomos del litio que estarán formando enlace metálico, se combinan entre sí para dar unos orbitales moleculares, pertenecientes a todo el cristal y con energías muy semejantes entre sí. Tan cercanos se hallan energéticamente estos orbitales moleculares formados, que decimos que dan lugar a una banda. Se obtienen tantos orbitales moleculares como orbitales atómicos se combinen.
La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una "banda de energía".
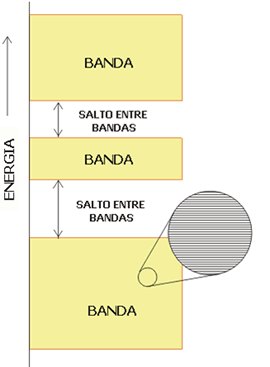
Por tanto, en los metales, hay bandas de valencia, que son bandas en las que se hallan los electrones de valencia y pueden estar llenas o semillenas, dependiendo de la configuración electrónica del metal, y bandas de conducción, que pueden hallarse vacías o parcialmente vacías y facilitan la conducción porque son energéticamente accesibles. De hecho, los metales son conductores porque las bandas de valencia y de conducción se superponen, y esto hace que los electrones se muevan con libertad de una a otra.
En el caso de los semiconductores, las bandas de valencia y de conducción no se superponen, pero la diferencia energética entre ambas es pequeña, por lo que una pequeña aportación energética hará que puedan promocionar electrones a la banda de conducción y, por tanto, conducir la corriente eléctrica.
En los aislantes, por su parte, las dos bandas están tan alejadas que la banda de conducción es inaccesible, motivo por el cual son incapaces de conducir la corriente:
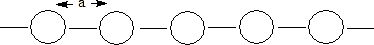
Para poder visualizar la formación de una banda considérese una distribución lineal de átomos (sólido unidimensional), separados todos a la misma distancia (a), en los que cada átomo posee un orbital de tipo s. Cada orbital de tipo s de un átomo solapará con el orbital s del átomo vecino. Así, si sólo hubiera dos átomos en el conjunto el solapamiento conduciría a la formación de 2 orbitales moleculares, uno de enlace y otro de antienlace. Si tenemos 3 átomos, el solapamiento de los 3 orbitales de tipo s originaría la formación de 3 orbitales moleculares, de enlace, de no enlace y de antienlace. A medida que se van añadiendo átomos al conjunto cada uno contribuye con su orbital molecular al solapamiento y en consecuencia se obtiene un nuevo orbital molecular. Así, cuando el conjunto está formado por N átomos se obtienen N orbitales moleculares. El orbital molecular de menor energía no presenta ningún nodo entre los átomos vecinos, mientras que el orbital molecular de mayor energía presenta un nodo entre cada par de átomos vecinos. 
Comentarios
Publicar un comentario