estructura de los materiales
(2.13) ESTRUCTURA DE LOS MATERIALES!
QUE ES LA ESTRUCTURA DE LOS MATERIALES?
QUE ES LA ESTRUCTURA DE LOS MATERIALES?
- . ESTRUCTURA DE LOS MATERIALES UNIDAD 2
- Relación estructura-propiedadesprocesamiento Para realizar su función un componente debe tener la forma correcta. Para esto se debe aprovechar la relación entre la estructura interna del material, su procesamiento y las propiedades finales del mismo. Cuando se modifica alguno de estos tres aspectos, cualquiera de los restantes también cambian.
- Estructura de un material La estructura de un material se puede considerar en diferentes niveles
- Estructura atómica La disposición de los electrones que rodean al núcleo de los átomos individuales afecta el comportamiento eléctrico, magnético, térmico y óptico. La configuración electrónica influye en la forma en que los átomos se unen entre si (enlaces químicos)
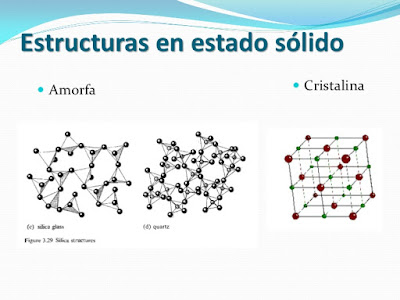
- Estructura Cristalina Es esta estructura se toma en consideración la disposición o arreglo de los átomos. Los metales, semiconductores, muchos cerámicos y algunos polímeros tienen una organización de átomos muy regular, es decir, una estructura cristalina. Se pueden controlar las imperfecciones en la organización atómica a fin de producir cambios profundos en las propiedades.
- Estructura Granular En la mayor parte de los metales, los semiconductores y cerámicos se encuentra una estructura granular. El tamaño y forma de los granos influye en el comportamiento del material.
- Estructura Multifásica En la mayor parte de los materiales se presenta mas de una fase, teniendo cada una de ellas su arreglo atómico y propiedades únicas. El control del tipo, tamaño, distribución y cantidad de estas fases dentro del material es otra de las principales formas de controlar las propiedades.
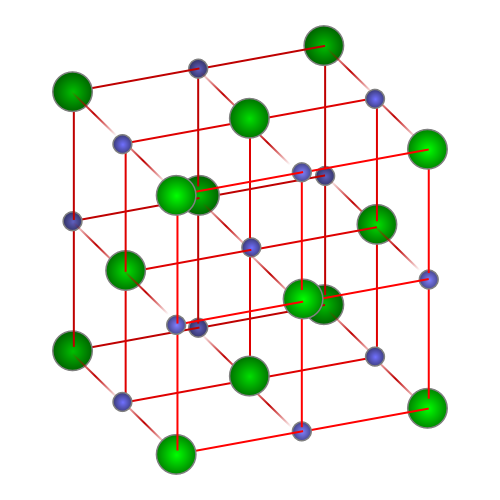
- Estructura cristalina y su consecuencia en las propiedades La estructura física de los materiales de ingeniería tiene importancia en cuanto a la disposición de los átomos, iones o moléculas que constituyen el solido y de las fuerzas de enlace entre ellos. Si están ordenados en una disposición que se repite en las tres dimensiones, se dice que el solido posee ESTRUCTURA CRISTALINA (metales, aleaciones y algunos materiales cerámicos.
- La disposición atómica en los solidos cristalinos forma una red espacial donde los átomos se encuentran en la intersección de una red de líneas en tres dimensiones, en otras palabras, es una disposición de puntos tridimensionales infinita.
- La red difiere de un material a otro tanto en tamaño como en forma, dependiendo del tamaño de los átomos y del tipo de enlace entre ellos. La celda unitaria es la subdivisión de la red cristalina que sigue conservando las características generales de toda la red. Al apilar celdas unitarias idénticas, se puede construir toda la red.
- Existen otro tipo de sustancias constituidas por moléculas finitas (figura 5.4) que contienen un número determinado de átomos unidos por fuertes enlaces covalentes primarios, estas moléculas carecen de electrones adicionales que les permitan enlazarse con las otras moléculas, de manera que la unión entre ellas se logra mediante interacciones débiles de baja energía. Esto justifica que sus puntos de fusión, y aun los de ebullición, sean más bajos que la temperatura ambiente, lo que determina que sean líquidos o gases a temperatura ambiente. Ejemplos de este tipo de sustancias son los gases nobles, el oxígeno, el hidrógeno el bióxido de carbono y algunas sustancias orgánicas, como el metano, los gases combustibles, los aceites y
- Tipos de materiales
Por conveniencia la mayoria de los materiales de la ingenieria estan divididos en tres grupos principales materiales metálicos , poliméricos , y cerámicos
Materiales metálicos .
Estos materiales son sustancias inorgánicas que están compuestas de uno o mas elementos metálicos , pudiendo contener también algunos elementos no metálicos , ejemplo de elementos metalicos son hierro cobre , aluminio , niquel y titanio mientras que como elementos no metalicos podriamos mencionar al carbono.
Los materiales de cerámica , como los ladrillos , el vidrio la loza , los ailantes y los abrasivos , tienen escasas conductividad tanto electrica como termica y aunque pueden tener buena resistencia y dureza son deficientes en ductilidad , conformabilidad y resistencia al impacto..
Polimeros , en estos se incluyen el caucho (el hule) , los plásticos y muchos tipos de adhesivos . Se producen creando grandes estructuras moleculares apartir de moléculas orgánicas obtenidas del petroleo o productos agrícolas .
Fases componentes de un sólido desde su estructura intermolecular
Una sustancia pura como el agua puede existir en las fases sólido, liquido y gas, dependiendo de las condiciones de temperatura y presión. Un ejemplo familiar para todos de dos fases de una sustancia pura en equilibrio es un vaso de agua con cubos de hielo. En este caso el agua, sólida y liquida, da lugar a dos fases distintas separadas por una fase limite, la superficie de los cubos de hielo. Durante la ebullición del agua, el agua líquida y el agua vapor son dos fases en equilibrio. Una representación de las fases acuosas que existen bajo diferentes condiciones de presión y temperatura se muestra en la
En el diagrama de fases presión-temperatura (PT} del agua existe un punto triple a baja presión (4579 torr) y baja temperatura (0,0098 0C) donde las fases sólida, liquida y gaseosa coexisten. Las fases liquida y gaseosa existen a lo largo de la línea de vaporización y las fases líquida y sólida a lo largo de la línea de congelación, como se muestra en la Figura 8.1. Estas lineas son lineas de equilibrio entre dos fases.
El díagrama de fases en equilibrio (PT) se puede construir también para otras sustancias puras. Por ejemplo, el diagrama de fases de equilibrio PT del hierro puro se muestra en la Figura 8.2. Una diferencia fundamental de este diagrama de fases es que tiene tres fases sólidas distintas y separadas: Fe alfa (~, Fe gamma (y) y Fe delta (~).
El hierro ~ y <5 tiene estructuras cristalinas BBC, mientras el hierro y tiene una estructura FCC. Las fases limite en el estado sólido tienen las mismas propiedades que entre liquido y sólido. Por ejemplo, bajo condiciones de equilibrio, el hierro ~ y y puede existir a una temperatura de 910 0C y una atmósfera de presión. Por encima de 910 0C sólo existe la fase y, y por debajo de 910 0C sólo existe la fase ~ Hay también tres puntos triple en el díagrama PT del hierro donde las tres fases diferentes coexisten: (1) líquido, vapor Fe <5; (2) vapor, Fe <5 y Fe y; y (3) vapor, Fe y y Fe ~.enlaces existente para su configuración
4. Enlaces existentes para su configuración.
Enlaces metálicos
En metales en estado sólido , los átomos se encuentran empaquetados relativamente muy juntos en una ordenación sistemática o estructura cristalina . Por ejemplo la disposición de los átomos de cobre en el cobre cristalino consiste que los átomos están tan juntos que sus electrones externos de valencia son atraídos por los núcleos de sus numeroso vecinos . En el caso del cobre sólido cada átomo está rodeado por otros 12 átomos más próximos . Los electrones de valencia no están por lo tanto asociados férreamente a un núcleo en particular y así es posible que se extiendan entre los átomos en forma de una nube electrónica de carga de baja densidad o gas electrónico. Los átomos en un enlace metálico sólido se mantienen juntos por enlace metálico para lograr un estado de más baja energía ( o más estable) . Para el enlace metálico no hay restricciones sobre pares electrónicos como en el enlace covalente o sobre la neutralidad de carga como en el enlace iónico . En el enlace metálico los electrones de valencia más externos de los átomos son compartidos por muchos átomos circundantes y de este modo , en general , el enlace metálico no resulta direccional Fuerzas de van der Waals
Excepto en un gas muy dispersado las moléculas ejercen atracciones y repulsiones entre sí . Estas proceden fundamentalmente de interacciones dipolo-dipolo . Las moléculas no polares se atraen entre sí mediante interacciones débiles dipolo-dipolo llamadas fuerzas de London que surgen como consecuencia de dipolos inducidos en una molécula por otra. En este caso los electrones de una molecula son debilmente atraídos hacia el nucleo de otra pero entonces los electrones de esta son repelidos por los electrones de la primera. El resultado es una distribución desigual de la densidad electrónica y , en consecuencia , un dipolo incluido . Las diferentes interacciones dipolo-dipolo (atractivas y repulsivas) se denominan conjuntamente fuerzas de van der Waals . La distancia entre las moléculas juega un importante papel en la intensidad de dichas fuerzas . Se llama radio de van der Waals a la distancia a la que la fuerza atractiva es máxima .Cuando dos átomos se aproxima a distancias mas cortas que el radio de van der Waals , se desarrollan fuerzas repulsivas entre los núcleos y las capas electrónicas . Cuando la distancia entre dos moléculas es mayor al radio de van der Waals las fuerzas atractivas entre las moléculas disminuyen.
Enlace iónico
Los enlaces iónicos se pueden formar entre elementos muy electropositivos (metálicos) y elementos muy electronegativos (no metales) . En el proceso de ionización los electrones son transferidos desde los átomos de los elementos electropositivos a los átomos de los elementos electronegativos , produciendo cationes cargados positivamente y aniones cargados negativamente . Las fuerzas de enlace son debidas a la fuerza de atracción electrostática o culombiana entre iones con carga opuesta . Los enlaces ionicos se forman entre iones opuestamente cargados por que se produce una disminución neta de la energía potencial para los iones enlazados
Enlace covalente
Un segundo tipo de enlace atómico primario es el enlace covalente . Mientras el enlace iónico involucra átomos muy electropositivos y electronegativos , el enlace covalente se forma entre átomos con pequeñas diferencias de electronegatividad y ubicados muy próximos en la tabla periódica . En el enlace covalnete los átomos generalmente comparten sus electrones externos s y p como otros átomos , de modo que cada átomo alcanza la configuración de gas noble. En un enlace covalente sencillo cada uno de los átomos contribuye con un electrón a la formación del par de electrones de enlace , y las energías de los dos átomos asociadas con el enlace covalente son menores (mas estables) como consecuencia de la interacción de los electrones . En el enlace covalente , se pueden formar enlaces mútiples de pares de eletrones por un átomo consigo mismo o con otros átomos.
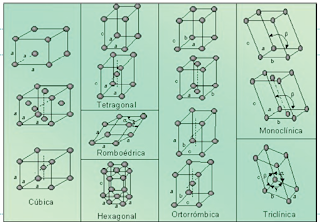
Redes cristalograficas existentes
Sistemas cristalográficos
Los cristalógrafos han demostrado que son necesarias solo siete tipos diferentes de celda unidad para crear todas las redes puntuales . La mayor parte de etos siete sistemas cristalinos presentan variaciones de la celda unida básica . A. J. Bravais mostró que catorce celdas unidad estándar podian describir todas las estructuras reticulares posibles .Hay cuatro tipos de celdas unidad :
- Sencilla
- Centrada en el cuerpo
- Centrada en las caras
- Centrada en la base
Hoy cumple 4 años exactamente de que esta información fue subida.
ResponderEliminar